本站讯 近日,中国海洋大学医药学院、海洋药物教育部重点实验室姜帅教授课题组在生物大分子的组装递送领域取得新进展,相关成果分别发表于国际知名学术期刊Angewandte Chemie International Edition(《德国应用化学》)和Advanced Science(《先进科学》)。
生物大分子的安全、可控递送对于合成生物学和药物递送领域具有重要意义。天然细胞通过多种功能模块的精确组装,实现内部过程的自主协调以执行复杂生理活动。其中,能量供应模块(如产生三磷酸腺苷(ATP)的线粒体)对维持细胞代谢至关重要。研究团队设计了一种具备自增强质子生成能力的人造线粒体(图1a),其中CAT可快速分解有毒中间体H₂O₂生成O₂,促进GOx的催化循环,显著提升质子产率并建立稳健的跨膜质子梯度以驱动ATP合成。与既有GOx驱动系统(ΔpH≈0.5)、g-C₃N₄光催化系统(ΔpH≈1.2)及金纳米颗粒-酸性磷酸酶系统(ΔpH≈0.7)相比,该体系可实现更强的质子驱动力(ΔpH≈1.4)(图1b)。将该人工线粒体嵌入巨型囊泡后,可在人工细胞内实现以葡萄糖为底物的ATP自供驱动NADH合成(图1c),展现出高效的能量转换与代谢耦联能力。该人造能量模块为实现自主能量供给的人工生命系统奠定了基础,并为自下而上的合成生物学发展提供了新的策略平台。
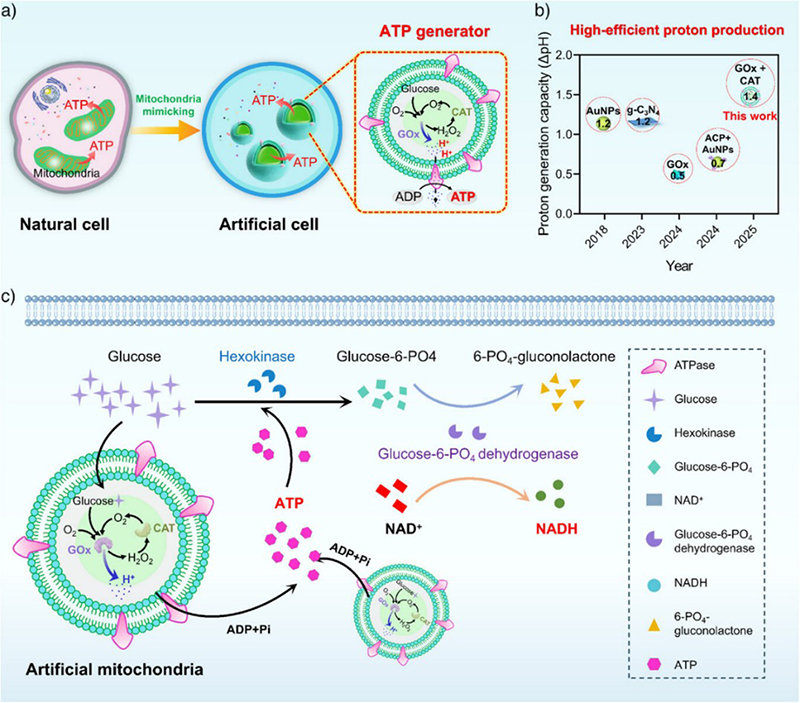
图1.自主能量供应人工细胞的构建及其在 NADH 生物合成中的应用示意图
纳米药物在体内递送过程中不可避免地与血液蛋白相互作用,形成的“蛋白冠”显著影响其在体内的分布及免疫反应。目前研究主要聚焦于纳米颗粒理化性质对蛋白冠的影响,但体内复杂且动态变化的生理微环境如何调控蛋白冠演化仍缺乏系统研究。纳米颗粒从血液(pH 7.4)进入肿瘤组织(pH≈6.5),再到细胞内溶酶体(pH 4.5-5.5)的过程中,pH的持续变化会影响蛋白质在颗粒表面的吸附、解离及构象转变,进而驱动蛋白冠的动态重塑。研究发现,在酸性环境下颗粒表面蛋白吸附量显著增加并伴随蛋白构象展开,促进了巨噬细胞(RAW264.7、dTHP-1)和肿瘤细胞(A549)对纳米颗粒的摄取(图1)。蛋白组学分析显示,酸性条件下蛋白冠中补体C3和免疫球蛋白含量下降,而调控性蛋白C4BPA及载脂蛋白(ApoA1、ApoE)富集,这一组成变化在增强细胞内吞的同时显著抑制了ROS生成与炎症因子(IL-1β、TNF-α、IL-6)的分泌,实现了“高摄取、低炎症”的双重调控效应。该研究系统阐明了pH驱动的蛋白冠动态重塑机制,及其对免疫识别和细胞互作的深远影响。
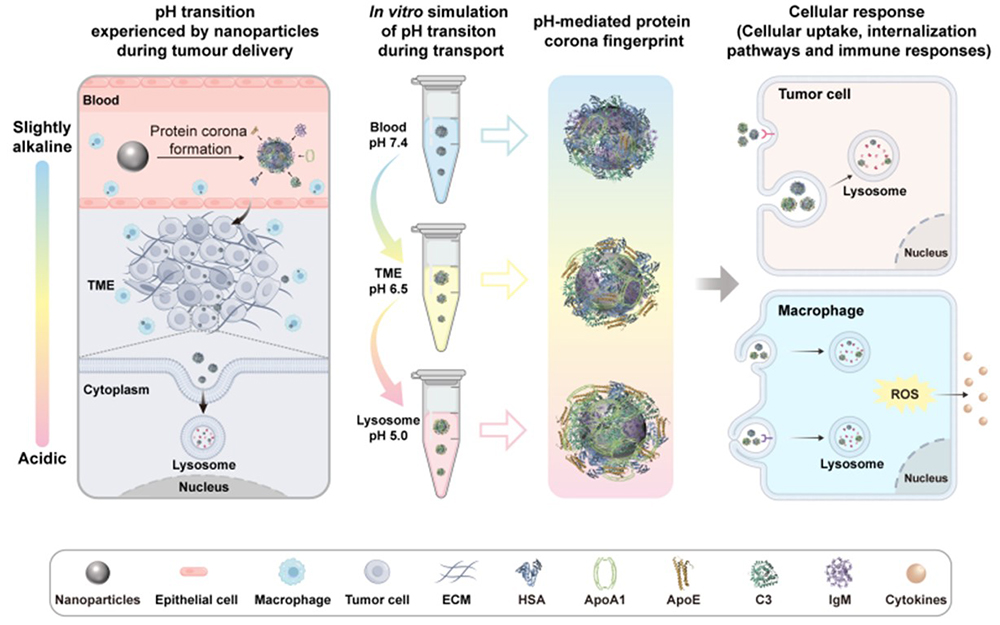
图2.生理pH变化对蛋白冠演化及其介导的细胞摄取和炎症反应的调控作用

图3.姜帅课题组合影(第三排中间为姜帅老师)
中国海洋大学为上述论文的第一通讯单位,医药学院姜帅教授、食品科学与工程学院毛相朝教授和德国马普高分子所Katharina Landfester教授分别为文章共同通讯作者,海大博士生葛雨婷、付芳琴和硕士生胡雪梅分别为文章第一(含共同)作者,相关工作得到了国家自然科学基金、山东省重点研发计划、山东省优青(海外)以及泰山学者等项目的支持。
文章链接:https://onlinelibrary.wiley.com/doi/10.1002/anie.202514980
编辑:赵奚赟
责任编辑:刘莅




































