本站讯 DNA N6-甲基腺嘌呤(6mA)是表观遗传学领域近年来备受关注的一种重要修饰。越来越多的证据显示,6mA参与真核生物的转录调控、核小体定位、DNA复制等过程,在压力应激、胚胎发育、细胞生理状态、植物生长发育、肿瘤细胞生长、免疫应答等方面发挥重要的生物学功能。解析真核生物6mA调控的分子机制,是深入理解其生物学功能的关键。
2025年5月,学校海洋生物多样性与进化研究所原生动物学团队高珊教授课题组在Science Advances(《科学进展》)杂志发表题为“Identification and characterization of the de novo methyltransferases for eukaryotic N6-methyladenine (6mA)”(真核生物DNA N6-甲基腺嘌呤〔6mA〕从头甲基化酶AMT2和AMT5的鉴定与刻画)的研究成果。这项研究以单细胞真核生物-嗜热四膜虫为材料,利用其接合生殖过程中无6mA的合子核发育为有6mA的子代新大核这一独特的时间窗口,鉴定了MT-A70家族蛋白AMT2和AMT5为6mA从头甲基化酶,并揭示了两者在6mA从头建立及细胞正常发育中的关键作用。
DNA甲基化的完整动态调控通路包含建立和维持两个过程。高珊教授团队前期鉴定并刻画了单细胞真核生物特有的6mA甲基化酶AMT1,揭示了其特异性偏好以ApT双核苷酸作为底物的特性。团队最新研究发现,AMT1可以分别和MT-A70家族的其它两个蛋白AMT6和AMT7形成两个独立的复合体,通过分别识别转录和复制的信号,共同实现基因组特定区域6mA的维持甲基化。但6mA从头甲基化如何建立,仍是一个有待解答的重要科学命题。
单细胞真核生物四膜虫具有独特的双元核型(同一个细胞里有一个大核和一个小核)和有性生殖过程(接合生殖)。无性生殖期间,6mA只分布于大核,在小核中完全缺失。而有性生殖时期,作为基因储存库的母代小核生成配子核、并进一步受精形成合子核。其中,部分合子核发育为子代新大核。在此过程中,没有6mA的合子核发育成有6mA的新大核,会发生全基因组范围的从头甲基化,为寻找6mA从头甲基化酶提供了理想的窗口期(图1)。
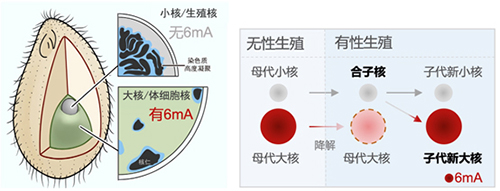
图1. 四膜虫是研究6mA从头甲基化的理想模式:在合子核发育为子代新大核的过程中,6mA完全从头建立。
通过同源序列比对和系统树构建,结合细胞学和遗传学验证,高珊教授团队将四膜虫MT-A70蛋白家族的7个6mA甲基化酶候选蛋白(AMT1-AMT7)划分为不同的功能组。如前所述,AMT1分别与AMT6和AMT7协同作用,主要执行维持性甲基化酶的功能。新近工作发现,AMT3和AMT4分别为METTL14和METTL3的同源蛋白,以RNA为底物催化形成m6A修饰。目前,仅有AMT2和AMT5的功能未得到验证。
该研究发现,AMT2和AMT5在有性生殖后期显著高表达,且特异性分布在新大核中,和6mA从头甲基化发生的时间节点和位置都高度吻合(图2A-B)。为了验证二者是否具有从头甲基化酶功能,研究团队构建了AMT2和AMT5单敲或双敲的纯合株系。免疫荧光染色和DNA小分子质谱结果均显示,敲除株系中6mA水平较野生型显著下降,降幅约为80%(图2C)。回补实验表明,野生型基因回补可有效恢复6mA水平,而酶活关键位点突变的回补则无法恢复,表明敲除引起的6mA下降与甲基化酶活性的丢失直接相关(图2C)。
为了进一步解析敲除株系中6mA模式的变化,团队对流式分选获得的子代新大核进行了三代单分子实时测序(SMRT-CCS)(图2D)。结果显示,AMT2/AMT5敲除导致新大核中的6mA位点显著减少,而少量残留位点的甲基化水平也明显下降。团队随后进一步筛选出一组不依赖于维持性甲基化酶AMT1的位点,发现这些位点在敲除株系中的甲基化水平几乎降至零。上述结果以单碱基分辨率、在单分子水平上证明了AMT2和AMT5对于新大核中6mA图谱的正确建立至关重要。
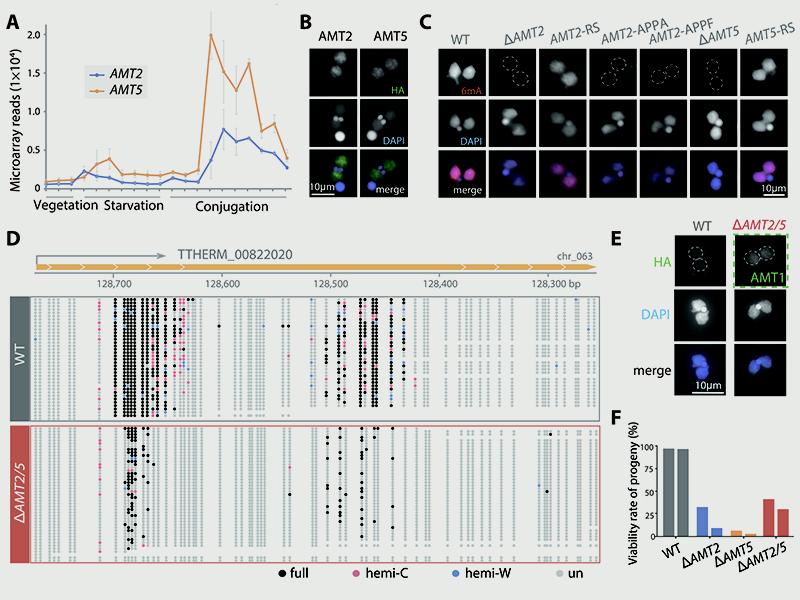
图2. AMT2和AMT5调控新大核中6mA的从头建立。(A)AMT2和AMT5在新大核发育时期高表达;(B)AMT2和AMT5定位在新大核;(C)AMT2/AMT5敲除导致新大核6mA水平下降,野生型AMT2/AMT5回补可使新大核中6mA水平恢复,突变回补不能使6mA水平恢复;(D)SMRT-CCS结果显示敲除株系中6mA位点数大量减少,甲基化水平显著下降;(E)敲除株系后代中AMT1蛋白水平相比野生型上调;(F)AMT2/AMT5敲除导致后代存活率下降。
值得注意的是,残留位点仍具有全甲基化(两条链上的A均被甲基化)和在基因5’端核小体连接DNA上富集等特征,符合维持性甲基化酶AMT1的催化特性。进一步分析发现,AMT1在新大核发育时期高表达,并在这一时期特异性定位在新大核中。更为重要的是,AMT2/AMT5敲除细胞中的AMT1蛋白水平发生明显上调(图2E)。团队此前的体外酶活实验已证明,AMT1能够以无甲基化DNA为底物进行从头甲基化。以上结果表明,在合子核发育为子代新大核的过程中,AMT1可以在AMT2和AMT5缺失的情况下部分代偿其功能,发挥从头甲基化的作用。但由于缺乏从头甲基化酶的基础性“铺垫”,AMT1的催化位点数量有限且甲基化效率低,从而从另一个侧面强调了AMT2和AMT5的催化活性是新大核中6mA从头建立的关键和限速步骤。
敲除株系中新大核6mA从头建立的破坏,导致四膜虫有性生殖过程出现延迟,后代存活率也大幅下降(图2F)。部分可存活后代在重新进入无性生殖周期后,由于AMT1蛋白水平的上调(图2E),其6mA可在整体水平上恢复到与野生型相当,但这些后代仍出现生长缓慢、提前性成熟等异常表型,提示虽然AMT1可在一定程度上补偿6mA水平,但从头甲基化的精确建立对细胞生长发育仍有不可替代的重要作用。
基于以上结果,团队提出了6mA的调控通路模型(图3):在野生型四膜虫中,无6mA的合子核发育为有6mA的新大核的过程中,从头甲基化酶AMT2和AMT5将未甲基化的腺嘌呤催化为半甲基化,随后由维持性甲基化酶AMT1将其进一步转化为全甲基化;进入无性生殖时期后,AMT1的持续高表达确保了6mA在细胞分裂过程中的稳定遗传。在AMT2/AMT5敲除细胞中,AMT1同时发挥(较弱的)从头甲基化酶和维持性甲基化酶活性,仅能在极少数位点添加6mA且甲基化水平显著偏低;当细胞进入无性生殖时期后,AMT1水平的升高使大量未甲基化位点可以被甲基化,但仍可能存在甲基化模式的紊乱。
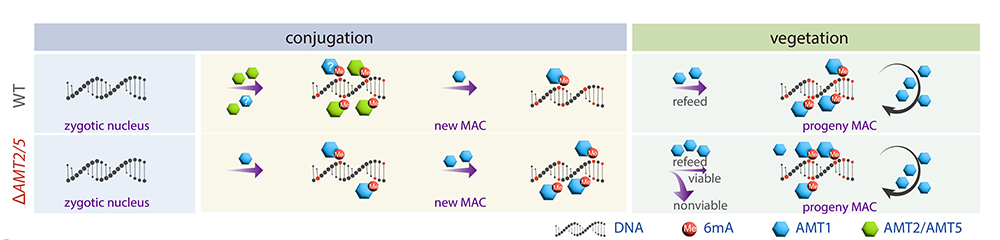
图3. 野生型及AMT2/AMT5敲除株系中6mA的调控通路模型。
该研究首次鉴定并刻画了真核生物中介导6mA添加的从头甲基转移酶,揭示了6mA修饰遵循建立–维持的两步甲基化模式。这一发现与经典的5-甲基胞嘧啶(5mC)形成了有趣的对应关系:二者均识别回文序列(ApT与CpG),以半保留的方式遗传,并依赖两步甲基化过程完成修饰。考虑到6mA主要存在于单细胞真核生物,而5mC广泛分布于多细胞生物,该研究从DNA甲基化的角度为理解真核生物的分化与进化提供了新的视角。
Science Advances同期发表由波兰分子和细胞生物学研究所Matthias Bochtler教授为该研究撰写的题为Introducing the “other” type of DNA methylation的聚焦评论。Bochtler教授肯定了该研究选择纤毛虫研究DNA甲基化的优势,提出了从头甲基化和维持甲基化过程对腺嘌呤和胞嘧啶上甲基化修饰的必要性。从DNA甲基化酶的组成讨论了四膜虫与高等真核生物的甲基化系统之间的显著相似性,并进一步讨论了纤毛虫为何会选择建立一种基于腺嘌呤甲基化的表观遗传系统,以及6mA从头甲基化酶在高等真核生物中是否存在的可能性。
该研究由学校海洋生物多样性与进化研究所原生动物学团队高珊教授课题组完成。高珊教授课题组博士生程婷、张佳晨、李海程、刁静涵为该文章的共同第一作者,高珊教授为文章的通讯作者。云南大学章文信副教授,高珊教授课题组博士生牛俊骅,日本基础生物学研究所Kensuke Kataoka副研究员、Takayuki Kawaguchi博士和Jun-ichi Nakayama教授对本文亦有重要贡献。
通讯员:张川
编辑:赵奚赟
责任编辑:刘莅




































