本站讯 近日,中国海洋大学医药学院、海洋药物教育部重点实验室、青岛海洋科技中心海洋药物与生物制品功能实验室、青岛海洋生物医药研究院李德海教授团队在国际顶级期刊J Am Chem Soc和Angew Chem Int Ed杂志分别发表题为“Sorbremnoids A and B: NLRP3 Inflammasome Inhibitors Discovered from Spatially Restricted Crosstalk of Biosynthetic Pathways(Sorbremnoids A和B:空间限制性生物合成途径串扰发现新型NLRP3炎症小体抑制剂)”和“Discovery, Total Synthesis, and Anti-inflammatory Evaluation of Naturally Occurring Naphthopyrone-Macrolide Hybrids as Potent NLRP3 Inflammasome Inhibitors(天然来源的萘并吡喃酮-大环内酯杂合体类NLRP3炎症小体抑制剂的发现、全合成和抗炎活性研究)”的系列研究成果。
炎症小体是天然免疫系统的重要组成部分,在机体炎症反应中发挥着重要的调控作用。NLRP3 炎症小体是目前研究最多最具代表性的一类,它与自身免疫性疾病、炎症性疾病、感染性疾病和神经退行性疾病等的发生发展密切相关,也是疾病药物开发的新靶标。
研究人员通过激活来源于滨海盐生植物Suaeda salsa的内生青霉菌Penicillium citrinum HDN11-186中沉默的生物合成基因簇,发现了三个具有新颖骨架结构的杂合天然产物(hybrid natural products,hbNPs):Sorbremnoid A(1)、Sorbremnoid B(2)和Sorbtalone(3)(图1)。在化合物1-3的生物合成过程中,三条完全独立的基因簇pci9,pci56和pcisor分别合成高度活泼的单体分子9a/b、scytalone-DH和sorbicillinol,通过区域和立体选择性的分子间Diels-Alder环化生成杂合二聚体。基于基因敲除、量子化学计算和荧光标记蛋白定位等实验,研究人员提出了细胞水平上一系列二聚体在空间范围内的生物合成过程。随后研究发现Sorbremnoid A通过直接靶向于NLRP3蛋白,发挥抑制NLRP3炎症小体组装和激活的强效作用,并在糖尿病小鼠难愈性伤口愈合模型中表现出良好的促进伤口愈合的效果。
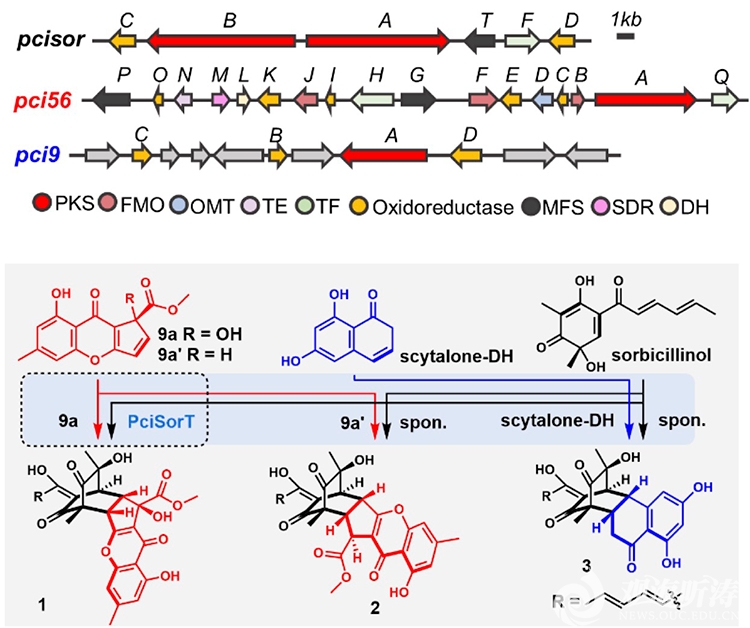
图1:多条基因簇串扰生成杂合新骨架天然产物
研究人员从采集自南极菲尔德斯半岛潮间带的沉积物样品中分离出一株假裸囊菌属(Pseudogymnoascus sp.)真菌,从该菌的代谢产物中分离鉴定了一系列具有独特多环骨架的萘并吡喃酮-大环内酯杂合体gymnoasins A-C (图2)。研究人员利用单体macrosphelide A和pannorin通过一锅法迈克尔加成/半缩酮化级联反应实现了gymnoasin A的化学全合成,在准确鉴定其化学结构的同时也解决了天然药物研究通常面临的药源限制问题。进一步研究发现,gymnoasin A在细胞水平和动物体内实验均能够通过特异性抑制NLRP3炎症小体而发挥抗炎作用(图2)。
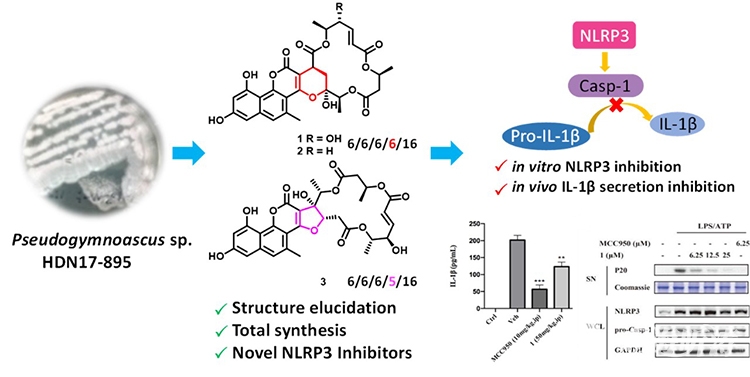
图2. Gymnoasins A−C的分离、全合成和生物活性研究
中国海洋大学为上述研究工作的第一和通讯单位,李德海教授为通讯作者;医药学院博士研究生张开金、毕业硕士生刘峻妤、江余祺副教授(Penicillium citrinum HDN11-186研究)和毕业博士生孙春晓、江余祺副教授、硕士毕业生李昌龙(Pseudogymnoascus sp.研究)分别为两篇文章的并列第一作者;两篇文章的共同作者还包括孙思敏、王融融、孙静贤、马传腾、陈颖涵、王文雪、侯学文、林家歧、周鲁宁、李丽萍、Mudassir Shah以及朱天骄教授、张国建教授、车茜副教授、Robert Keyzers副教授、王德副教授和刘明教授。研究工作得到国家自然科学基金、青岛海洋科技中心科技创新项目、山东省泰山学者青年专家项目、山东省自然科学基金重大基础研究项目和国家留学基金委等项目的资助。

团队合影(第二排右一为李德海教授)
文章链接:
编辑:袁艺
责任编辑:李华昌




































