本站讯 海洋活性肽是海洋天然产物的重要组成部分,具有抗肿瘤、抗病毒、抗菌和镇痛等多样生物活性,也是海洋药物研发的主要来源之一。其中,海洋约束肽是一类兼具抗体和小分子双重属性的“微蛋白”,具有较高的成药潜力。近日,中国海洋大学江涛教授和于日磊副教授团队在海洋约束肽研究领域取得多项新进展,分别于1月31日、2月26日在国际顶尖药学期刊《药物化学》(Journal of Medicinal Chemistry)在线发表了关于鲎素及其微生物耐药机制研究(DOI:10.1021/acs.jmedchem.9b01563)和芋螺毒素研究(DOI: 10.1021/acs.jmedchem.9b01536)系列成果。
鲎素TPI对于革兰氏阳性菌、革兰氏阴性菌、真菌等具有广谱抗菌活性,是良好的抗菌肽类药物先导化合物。然而,由于TPI具有较强的溶血活性、不稳定且易被降解等缺点,大大限制其临床应用。本研究团队合成了TPI的D型氨基酸类似物TPAD,跟野生TPI相比,TPAD的溶血活性降低,血浆稳定性显著提高,具有较高的生物安全性。研究人员通过原子力显微镜观察到TPAD可以进入细菌细胞膜,导致细菌内液外漏而引起细菌死亡。研究人员还发现TPAD的使用并不会诱导细菌耐药性的大幅度提高,细胞膜上的QseC/B双组分系统在TPAD作用下发生了上调,导致抗菌肽被大量外排,从而使L. enzymogenes YC36对TPAD产生一定耐药性(图1)。考虑到QseC/B双组分系统在TPAD引发耐药过程中扮演重要角色,研究者提出TPAD和LED209(QseC/B双组分系统的特异性抑制剂)的联合用药可以增强抗菌药效。活性测试结果显示2μg/mL的TPAD和5pM的LED209联用可完全杀死野生型L. enzymogenes YC36。
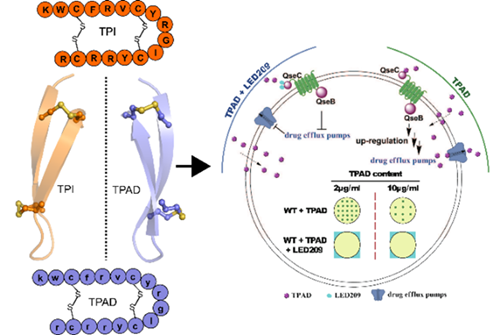
图1:鲎素结构与作用机制
芋螺毒素是由海洋软体动物芋螺的毒液管和毒囊内壁的毒腺所分泌的一系列富含二硫键的海洋约束肽,其能够特异性地靶向细胞膜上的不同离子通道受体,从而具有重要的药用潜力。研究人员前期研究发现肿瘤细胞镇痛靶标α9α10 nAChR存在两个相邻的芋螺毒素作用位点(J. Med. Chem. 2018, 61(10): 4628-4634),因此可利用“多价效应”设计芋螺毒素二聚体,提高芋螺毒素的活性。研究人员选用合适长度PEG连接臂,采用Click反应分别偶联了Vc1.1、 RgIA#和PeIA获得它们的二聚体。电生理学活性测试发现,它们针对α9α10 nAChR的抑制活性都大幅度被提高,其中PeIA-dimer对人源α9α10 nAChR的抑制活性达到1.9 ± 0.1 nM,是迄今为止靶向该靶点活性最强的抑制剂。另外,研究发现RgIA-dimer表现出对α9α10和α7 nAChR的双重抑制,其IC50=~50 nM,是目前首个同时靶向α9α10和α7 nAChR的双重抑制剂。最后,研究者阐明了芋螺毒素二聚体在分子水平上的作用机制,指出PEG连接臂的长度与物理化学特性将会影响芋螺毒素二聚体对不同nAChR亚型的活性与选择性(图2)。

图2:芋螺毒素RgIA#-dimer分别跟α9α10和α7 nAChR作用的复合物模型
以上系列研究成果为新型抗菌肽药物及镇痛药物的研发,提供了极具开发潜力的药物先导分子,后续动物活性实验均在开展过程中。同时,该成果也是中国海洋大学王岩教授研究组在细菌耐药机制研究方面(mBio,2019;10(3):e00676-00619;AEM,2019;85(23);AEM, 2017;83(17))取得的新进展。
中国海洋大学医药学院于日磊副教授和海洋生命学院王岩教授为鲎素研究文章共同通讯作者;医药学院博士研究生梁家珍为芋螺毒素研究文章第一作者,于日磊副教授为通讯作者。该研究由中国海洋大学优青培育计划、国家自然科学基金、青岛海洋科学与技术试点国家实验室山东省重点项目、国家重大科技新药创制项目、中国科协青年人才托举工程等资助。江涛教授、张晓华教授等为本研究提供了大力支持。澳大利亚昆士兰大学、卧龙岗大学及香港理工大学为本项目的合作单位。
文章链接:https://pubs.acs.org/doi/pdf/10.1021/acs.jmedchem.9b01563
文章链接:https://pubs.acs.org/doi/pdf/10.1021/acs.jmedchem.9b01536
编辑:冯文波
责任编辑:冯文波




































