本站讯 近日,中国海洋大学海洋生命学院、海洋生物多样性与进化教育部重点实验室、深海圈层与地球系统前沿科学中心张玉忠教授团队与刘鲁宁教授合作,在Science Advances杂志发表了题为“Molecular principles of the assembly and construction of a carboxysome shell”(羧基壳组装和构建的分子原理)的研究论文。该研究利用合成生物学技术设计、构建了包含所有外壳蛋白及关键连接蛋白CsoS2羧基末端结构域(CsoS2-C)的人工羧酶体外壳,解析了羧酶体外壳的结构以及各个蛋白组份之间的复杂相互作用,为研究羧酶体外壳自组装的分子机制提供了新见解,并为羧酶体的重构和生物技术应用提供了理论基础。
提高酶和代谢的效率是细胞维持生命的关键。通过细胞内的自组装和分区来隔离生物反应,是实现这一目标的重要方式。越来越多的证据表明,原核细胞中也含有类似真核细胞的细胞器结构。这些多样的类细胞器结构具有多种代谢和生理功能,促进了细胞对不同环境的适应,并推动了细胞复杂性的进化。
羧酶体是一种专门用于固定CO₂的微区室。其利用由六聚体、五聚体和三聚体组成的多面体蛋白质外壳封装Rubisco酶,通过提高Rubisco周围的CO₂浓度来增强羧化反应。利用羧酶体实现CO₂高效固定的主要类群包括蓝藻和化能自养细菌,它们在全球碳循环中发挥重要作用。此外,羧酶体的高CO2固定效率及其蛋白质外壳的封装特性,在作物的基因工程改造、代谢调控,以及作为纳米反应器在生物能源生产等方面具有很好的应用价值。尽管羧酶体具有重要生理生态功能和应用潜力,但其外壳组装的分子机制仍不清楚。这严重限制了对羧酶体整体结构的认识和改造利用。
本研究分析了人工合成的包含所有外壳蛋白和关键连接蛋白CsoS2羧基末端结构域(CsoS2-C)的α-羧酶体壳的结构。通过对最大尺寸54纳米的壳体组装结构进行原子分辨率的冷冻电镜分析,揭示了促进了更大尺寸外壳的稳定组装的羧酶体壳蛋白之间多样化的组装界面以及CsoS2与壳蛋白的详细相互作用。研究发现不同于六聚体-五聚体蛋白组件之间形成固定的倾角,六聚体与六聚体组件之间的倾角更加复杂多变。而连接蛋白的羧基末端结构域CsoS1C与外壳蛋白之间形成多点式相互作用,且采取两种不同的构象协助外壳的组装。不仅如此,基于生物化学和晶体结构学方法,研究还发现六聚体和五聚体单体蛋白的同源物之间可以形成异源嵌合六聚体和异源嵌合五聚体。
研究结果显著加深了我们对羧酶体壳自组装机制的认识,为揭示α-羧酶体壳的组装原理及CsoS2在调控α-羧酶体组装和功能中的作用提供了机制性见解,并为具有新生物技术功能的壳结构的设计和重新编程提供重要基础。
本研究由中国海洋大学、英国利物浦大学、山东大学等单位合作完成,中国海洋大学王鹏副教授、李康副教授、山东大学李剑勋博士和英国利物浦大学李天佩博士为共同第一作者。刘鲁宁教授、张玉忠教授为该论文的共同通讯作者,中国海洋大学为第一完成单位和通讯作者单位。本研究得到了科技部重点研发项目、国家自然科学基金的资助。
通讯员:李春阳
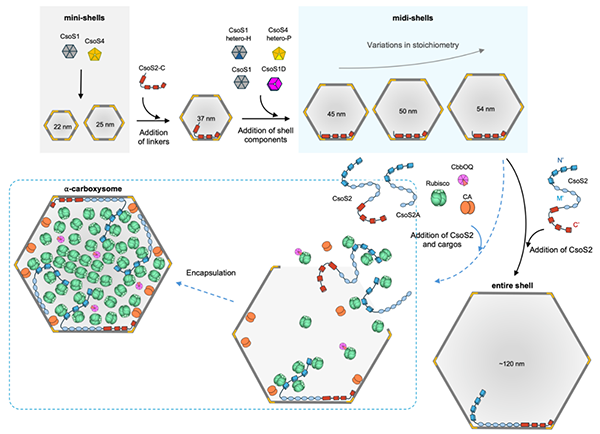
图1. CsoS2介导的α-羧酶体外壳组装及完整α-羧酶体的构建模型。
相关链接:https://www.science.org/doi/10.1126/sciadv.adr4227
编辑:赵奚赟
责任编辑:刘莅


